Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar → 1. Bölüm
İçindekiler
- 1. Bölüm: Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- FeS Oluşum Tepkimesi – Bir Kimyasal Tepkime
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
- Kimyanın Temel Kanunları
DERS
TYT Kimya
Kimya 10
KONU
ÜNİTE I
KİMYANIN TEMEL KANUNLARI VE KİMYASAL HESAPLAMALAR
I. Bölüm
KİMYANIN TEMEL KANUNLARI VE KİMYASAL HESAPLAMALAR
Bu ünitenin 4 ana bölümü vardır:
1- Kimyanın Temel Kanunları
2- Mol Kavramı
3- Kimyasal Tepkimeler ve Denklemler
4- Kimyasal Tepkimelerde Hesaplamalar
TYT Sınavında Çıkmış Soru Sayıları
| Yıl | 2023 | 2022 | 2021 | 2020 | 2019 | 2018 |
| Soru Sayısı | 1 | 1 | 1 | 1 | 0 | 1 |
1. Bölüm: Kimyanın Temel Kanunları
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Süre: 40 dakika
- Gerekli Bilgiler:
- Kimyanın Sembolik Dili
- Matematik: Sayılar, Üslü İfadeler, Oran Orantı
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- Kimyanın Temel Kanunları
- Kütlenin Korunumu Kanunu
- Sabit Oranlar Kanunu
- Katlı Oranlar Kanunu
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Kimyanın Temel Kanunları
Kimyanın Temel Kanunları Nedir?
- Kimyasal olayların nasıl gerçekleştiğini açıklayan kanunlardır.
- Olayların kanunlarını bilmek, olayları kontrol etme gücü kazandırır.
“Pers kralı olmaktansa bir doğa yasası bulmayı yeğlerim.” (Democritus)
Kimyanın Temel Kanunları Hangileridir?
- Kimyanın 3 temel kanunu vardır. Bunlar şunlardır:
- Kütlenin Korunumu Kanunu
- Sabit Oranlar Kanunu
- Katlı Oranlar Kanunu
Kimyanın Temel Kanunları
1. Kütlenin Korunumu Kanunu – 1774
Kütle (m)
- Değişmeyen madde miktarına kütle denir.
- Sembolü, “m” harfidir.
- Kütlenin birimi “gram” ve katlarıdır.
- Kütle, eşit kollu terazi ile ölçülür.

Kanun Kime Ait?

Kanun Ne Diyor?
- Bir fiziksel veya kimyasal tepkimede, tepkimeye giren maddelerin toplam kütlesi, ürünlerin toplam kütlesine eşittir.
mgirenler = mürünler
Kanun Nerede Geçerlidir?
- Bütün fiziksel ve kimyasal tepkimelerde geçerlidir.
Kimyanın Temel Kanunları
1. Kütlenin Korunumu Kanunu – 1774
Tepkime Nasıl Bir Şeydir?
- Tepkime demek “olay” veya “reaksiyon” demektir.
- Tepkimeler; tepkime denklemleri ile gösterilir.
- Tepkime denklemlerinde, her zaman bir tepkime oku (→) vardır.
- Farklı maddelerin aralarına “+ işareti” konulur.
- Tepkimelerde, okun sol tarafındaki maddelere girenler, sağ tarafındaki maddelere ürünler denir.
Girenler → Ürünler
- Girenler, tepkimeyi gerçekleştiren maddelerdir.
- Ürünler, tepkime bittikten sonraki maddelerdir.
- Bütün tepkimelerde, giren maddeler ürünlere dönüşür.
Fe + S → FeS
FeS Oluşum Tepkimesi – Bir Kimyasal Tepkime
Tepkimesi
Kimyanın Temel Kanunları
1. Kütlenin Korunumu Kanunu – 1774
Örnek:
Demir (Fe) ile kükürt (S) elementleri aşağıdaki tepkimeye göre FeS (Demir II Sülfür) bileşiğini oluşturur.
Fe + S → FeS
Buna göre, bu tepkimede 21 gram demir ile 12 gram kükürt elementinin tam tepkimesinden en fazla kaç gram demir II sülfür bileşiği oluşur?
Kimyanın Temel Kanunları
1. Kütlenin Korunumu Kanunu – 1774
Örnek:
A + B → C + D
Yukarıdaki kimyasal tepkimeye 23 gram A maddesi ile 35 gram B maddesi katılmıştır.
Tepkime sonunda 5 gram D maddesi oluştuğuna göre, bu tepkimede kaç gram C oluşmuştur?
Kimyanın Temel Kanunları
1. Kütlenin Korunumu Kanunu – 1774
Örnek:
Mg + 1/2O2 → MgO
Yukarıdaki tepkime denkleminde, Magnezyum (Mg) metali, havadaki oksijen (O2) gazı ile yanarak, MgO (Magnezyum oksit) bileşiğine dönüşüyor.
Tepkimede 12 gram magnezyumun yanmasından 20 gram magnezyum oksit bileşiği elde ediliyor. Buna göre, bu tepkimde kaç gram oksijen gazı harcanmıştır?
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Kanun Kime Ait?

Kanun Ne Diyor?
- Bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır.
Kanun Nerede Geçerlidir?
- Bu kanun, bütün bileşiklerde geçerlidir.
Bileşik Nedir?
- Elementleri sembollerinden, bileşikleri formüllerinden tanırız.
- H2O : Su
- NaCl : Yemek tuzu veya sodyum klorür
- FeS : Demir-II-sülfür
- CO2 : Karbon dioksit
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Öğretici Örnek:
X2Y bileşiğindeki elementlerin kütlece birleşme oranı şöyle olsun:
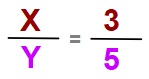
Bu durumda bu bileşik için şunlar doğrudur:
- Bileşikteki X elementi 3 gram ise;
- Y elementi 5 gramdır.
- Bu durumda bileşik (3+5) 8 gram olur.
- Bileşikteki X elementi 30 gram ise;
- Y elementi 50 gramdır.
- Bileşik toplam 80 gram olur.
- Bileşikteki Y elementi 25 gram ise;
- X elementi 15 gramdır.
- Bileşik toplam 40 gram olur…
- X2Y bileşiği elde etmek için 3 gram X elementi kullanıyorsak;
- Y elementi mutlaka 5 gram olmalıdır.
- 8 gram X2Y bileşiği elde etmek istersek;
- 3 gram X ve
- 5 gram Y elementini tepkimeye sokmalıyız.
- 8 gram X2Y bileşiğinin;
- 3 gramı X elementi,
- 5 gramı Y elementidir…
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Bileşikteki Sabit Oran Nasıl Hesaplanır?
- Bileşiğin formülüne bakılır.
- Atomların ağırlıklarına bakılır.
- Bileşik formülündeki atomların ağırlıkları, sorunun sonunda ve parantez içinde verilir.
Örnek:
CO2 (Karbon dioksit) bileşiğinde, C (Karbon) ve O (Oksijen) arasındaki sabit oran kaçtır? (C:12, O:16)
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Örnek:
CO2 (Karbon dioksit) bileşiğinde, C (Karbon) elementinin kütlesinin, bileşiğin toplam kütlesine oranı kaçtır? (C:12, O:16)
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Örnek:
36 gram H2O bileşiğinde 4 gram hidrojen (H) vardır.
Bu durumda bu bileşikteki elementlerin sabit oranı kaçtır?
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Örnek:
Fe2O3 bileşiğinde, kütlece %30 oksijen atomu bulunmaktadır.
Buna göre Fe2O3 bileşiğindeki mFe / mO oranını bulunuz.
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Örnek:
H2O üretmek için hidrojen (H) ve oksijen (O) gazları tepkimeye sokuluyor. Tepkimede 30 gram H elementi kullanılıyor.
Artan olmaması için, oksijenden kaç gram kullanılmalıdır? (H:1, O:16)
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Örnek:
MgO bileşiğinin kütlece %40’ı oksijendir. Buna göre:
a) 18 gram Magnezyum ile kaç gram Oksijenin tepkimeye gireceğini hesaplayınız.
b) 75 g MgO bileşiğinde kaç gram Magnezyum ve Oksijen olur?
Kimyanın Temel Kanunları
2. Sabit Oranlar Kanunu – 1799
Örnek:
NH3 (Amonyak) bileşiğinde, elementlerin kütlece birleşme oranı H/N = 3/14 tür.
Buna göre, eşit miktardaki azot (N) ve hidrojenden (H) 85 gram Amonyak elde edildiğine göre hangi elementten kaç gram artar?
Kimyanın Temel Kanunları
3. Katlı Oranlar Kanunu – 1804
Kanun Kime Ait?

Kanun Ne Diyor?
- Aynı iki elementten oluşan, iki farklı bileşikte, elementlerin birinin miktarı eşitken, diğer elementin miktarları arasında katlı bir oran vardır.
Kanun Nerede Geçerlidir?
- Bileşik çiftlerinde geçerlidir.
- Bileşik çiftlerinin şu özellikleri taşıması gerekir:
- Aynı elementlerden oluşmalı
- 2 tür element olmalı
- Sadeleşmiş formülleri mutlaka farklı olmalıdır (Katlı oran hiç bir zaman 1 çıkamaz.).
Örnek:
I) H2O ve CO2
II) H2SO4 ve H2SO3
III) C2H4 ve C3H6
IV) CH4 ve C3H8
Yukarıdaki bileşik çiftlerinden hangileri, Katlı Oranlar Yasasına uyar?
Kimyanın Temel Kanunları
3. Katlı Oranlar Kanunu – 1804
Katlı Oran Nasıl Hesaplanır?
- Bir element eşitlenir, diğer elementin katlı oranı bulunur.
Örnek:
CH4 ve C3H8 bileşiklerinde, Karbonlar (C) arasındaki katlı oran kaçtır?
Kimyanın Temel Kanunları
3. Katlı Oranlar Kanunu – 1804
Örnek:
| I. Bileşik | II. Bileşik | |
| Bileşiğin formülü | N2O3 | NO2 |
Yukarıdaki tabloda verilen bileşikler için;
a) Aynı miktarda Oksijen (O) ile birleşen Azotlar (N) arasındaki katlı oran nedir?
b) Aynı miktarda Azot (N) ile birleşen Oksijenler (O) arasındaki katlı oran nedir?
Kimyanın Temel Kanunları
3. Katlı Oranlar Kanunu – 1804
Örnek:
Karbon (C) ve Hidrojenden (H) oluşmuş iki farklı bileşik için şu bilgiler veriliyor:
I. Bileşikte, 24 gram C ve 8 gram H vardır.
II. Bileşikte, 36 gram C ve 4 gram H vardır.
Bu bilgilere göre, I. bileşikteki Hidrojenin, II. bileşikteki Hidrojene katlı oranı kaçtır?
Kimyanın Temel Kanunları
3. Katlı Oranlar Kanunu – 1804
Örnek:
24 gram C ve 4 gram H elementleri tamamen birleşerek C2H4 bileşiğini oluşturmaktadır.
Aynı elementlerin oluşturduğu başka bir bileşikte 12 gram C ile 3 gram H elementi birleştiğine göre bu bileşiğin formülü aşağıdakilerden hangisi olur?
A) CH4
B) C3H8
C) C2H6
D) C4H8
E) C3H6
Kimyanın Temel Kanunları
3. Katlı Oranlar Kanunu – 1804
Örnek:

Kükürt (S) ve Oksijen (O) elementlerinin oluşturduğu faklı iki bileşikte, elementlerin birleşen kütleleri grafikte verilmiştir. Grafiğe göre;
a) Aynı miktar Oksijen ile birleşen Kükürt miktarları arasındaki katlı oran nedir?
b) 8 gram Kükürt içeren I. ve II. bileşiklerin kütlelerini hesaplayınız.

Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar
I. Bölüm
(Kimyanın Temel Kanunları)
Bitti 🙁