Modern Atom Teorisi → 3. Bölüm
İçindekiler
- 3. Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
- Periyodik Özellikler
DERS
AYT Kimya
Kimya 11
KONU
ÜNİTE I
MODERN
ATOM
TEORİSİ
III. Bölüm
3. Periyodik Özellikler
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Süre: 40 dakika
- Gerekli Bilgiler:
- Atom ve Periyodik Sistem
- Kimyasal Tepkime Denklemleri
- Öğretmen:
- Gökalp AY
Anlatılacak Başlıklar*:
- Periyodik Özellikler
- Atom/İyon Yarıçapı Eğilimi
- İyonlaşma Enerjisi Eğilimi
- Elektron İlgisi Eğilimi
- Elektronegatiflik Eğilimi
- Metalik ve Ametalik Eğilimi
- Oksit ve Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Periyodik Özellikler
Periyodik Özellik Nedir?
- Periyodik sistemde, herhangi bir yöne doğru giderken genellikle artan ya da azalan özelliklere periyodik özellikler denir.

Periyodik Özellikler Nelerdir?
- Atom/İyon Yarıçapı Eğilimi
- İyonlaşma Enerjisi Eğilimi
- Elektron İlgisi Eğilimi
- Elektronegatiflik Eğilimi
- Metalik ve Ametalik Eğilimi
- Oksit ve Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
Periyodik Özellikler
1. Atom/İyon Yarıçapı Eğilimi
Metalik Yarıçap Nedir?

- Metalik bağ kurmuş ve katı haldeki atomlarının çekirdekleri arasındaki mesafenin yarısıdır.
Kovalent Yarıçap
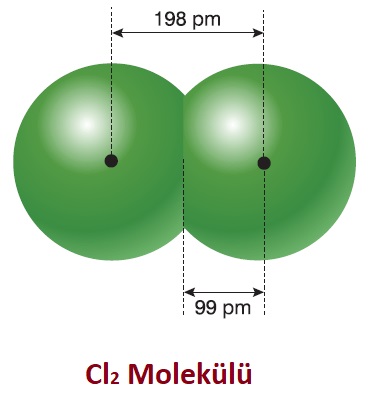
- Kovalent bağ kurmuş, iki ametal atomunun çekirdekleri arasındaki mesafenin yarısıdır.
Van der Waals Yarıçapı
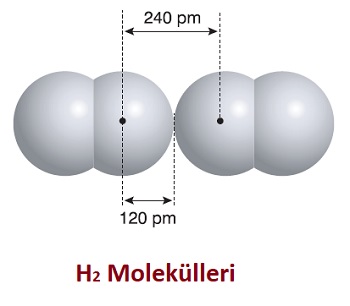
- Van der Waals bağı kurmuş ve katı haldeki iki atomunun çekirdekleri arasındaki mesafenin yarısıdır.
Periyodik Özellikler
1. Atom/İyon Yarıçapı Eğilimi
Atomların Yarıçapları Nasıl Karşılaştırılır?
- Atomların elektron dağılımına bakılır ve şu kurallar uygulanır:
- Yörünge sayısı daha fazla olan atomun yarıçapı daha büyüktür.
- Yörünge sayıları eşitken, proton sayısı daha az olan atomun yarıçapı daha büyüktür.
- Proton sayıları da eşitse, elektron sayısı daha fazla olan atomun yarıçapı daha büyüktür.
- Yörünge sayıları eşitken, proton sayısı daha az olan atomun yarıçapı daha büyüktür.
- Atomun yarıçapı daha büyükse, çapı ve hacmi de daha büyüktür.
Örnek:
16S16 )2e– )8e– )6e–
10Ne10 )2e– )8e–
5B5 )2e– )3e–
Yukarıda elektron dizilimleri verilen atomların hacimlerini karşılaştırınız.
Periyodik Özellikler
1. Atom/İyon Yarıçapı Eğilimi
İyonik Yarıçap
- Atomlar elektron verince çapları küçülür.
- Atomlar elektron alınca çapları büyür.
(Elektron vermek kilo vermeye, elektron almak kilo almaya benzetilebilir.)
Örnek:
X, X+3, X-1 atom ve iyonlarının çaplarını kıyaslayınız.
Periyodik Özellikler
1. Atom/İyon Yarıçapı Eğilimi
Periyodik Sistemde Atom Yarıçapı
- Aşağı ve sola gidildikçe atom yarıçapı artar.
- En şişman atom Fransiyumdur (Fr).

Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
İyonlaşma Enerjisi Nedir?
- Gaz halindeki nötür bir atomdan, 1 elektron koparmak için gereken enerjiye 1. iyonlaşma enerjisi denir.
X(g) + 130 kj/mol → X(g)+1 + 1e–
Elektron Sayısı Kadar İyonlaşma Enerjisi Vardır
- 1. iyonlaşma enerjisi (1.İ.E.):
X(g) + 130 kj/mol → X(g)+1 + 1e– - 2. iyonlaşma enerjisi (2.İ.E.):
X(g)+1 + 296 kj/mol → X(g)+2 + 1e– - 3. iyonlaşma enerjisi (3.İ.E):
X(g)+2 + 517 kj/mol → X(g)+3 + 1e– - …
Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
Örnek:
X(g)+1 + 2670 kj/mol → X(g)+4 + 3e–
Yukarıdaki tepkimede görülen 2670 kj/mol değerindeki enerji, atomun kaçıncı iyonlaşma enerjisidir?
Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
Elektronu Azalan Atomda Neler Olur?
- Atomdan elektron kopardıkça:
- Atomun elektron sayısı azalır.
- Atomun çapı küçülür.
- Elektron başına düşen çekim gücü artar.
- Bu yüzden, sonraki elektron daha zor kopar.
- Çekirdeğin çekim gücü değişmez.
Bir Sonraki Elektron Daha Zor Kopar
- Atomda her zaman bir sonraki elektronu daha zor koparırız.
- Her zaman bir sonraki iyonlaşma enerjisi değeri daha büyüktür:
1.İ.E. < 2. İ.E. < 3. İ.E. < 4. İ.E. < 5. İ.E.…
- Her zaman bir sonraki iyonlaşma enerjisi değeri daha büyüktür:
Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
Üç Buçuk (3.5) Kat Kuralı
- Kaçıncı iyonlaşma enerjisinden sonraki değer en az 3,5 kat artmış ise, atomun son yörüngesinde o kadar sayıda elektron var demektir.
Örnek: Aşağıdaki atomların grup numaralarını bulunuz.
| Atom | 1. İ.E. (kj/mol) | 2. İ.E. (kj/mol) | 3. İ.E. (kj/mol) | 4. İ.E. (kj/mol) |
|---|---|---|---|---|
| X | 1312 | – | – | – |
| Y | 2372 | 5298 | 11850 | – |
| Z | 577 | 1816 | 2744 | 11577 |
| T | 520 | 7298 | 11815 | 15577 |
| Q | 453 | 798 | 915 | 1577 |
Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
Farklı Atomların İyonlaşma Enerjilerine Göre Sıralanması
- Atomların elektron dağılımına bakılır:
- Değerlik elektron sayısı daha çok olan atomun iyonlaşma enerjisi daha büyüktür.
- Değerlik elektron sayıları eşit olan atomlardan çapı küçük olanın iyonlaşma enerjisi daha büyüktür.
Örnek:
12Mg, 20Ca ve 10Ne atomlarının 1. ve 3. iyonlaşma enerjilerini kıyaslayınız.
Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
Peş Peşe Gelen Atomlarda 1. İyonlaşma Enerjisi
- Aynı periyotta, ardışık atomların 1. iyonlaşma enerjisi sıralaması, gruplarına göre şöyledir:
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
(3 aşağı 5 yukarı)

Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
Örnek:

Periyodik Özellikler
2) İyonlaşma Enerjisi (İE) Eğilimi
Periyodik Sistemde İyonlaşma Enerjisi
- 1. iyonlaşma enerjisi en büyük atom helyumdur.
- Elektronu en zor veren atomdur.

Periyodik Özellikler
3) Elektron İlgisi (Eİ)
Elektron İlgisi Nedir?
- Gaz hâlindeki nötr bir atomun elektron alarak negatif yüklü iyon oluşturması sırasındaki enerji değişimine elektron ilgisi denir.
- Elektron ilgisi “E.İ.” ile gösterilir.
X(g) + e– → X(g)-1 + 235 kj/mol
Y(g) + e– → Y(g)-1 + 75 kj/mol
- Elektron ilgisi “E.İ.” ile gösterilir.
- Soy gazların elektron ilgileri çok düşük ve sıfıra yakındır.
- Ametallerin elektron ilgileri çok yüksektir.
- Metaller elektron almaya değil de vermeye ilgi duydukları için, metallerin de elektron ilgisi düşüktür.
Periyodik Özellikler
3) Elektron İlgisi (Eİ)
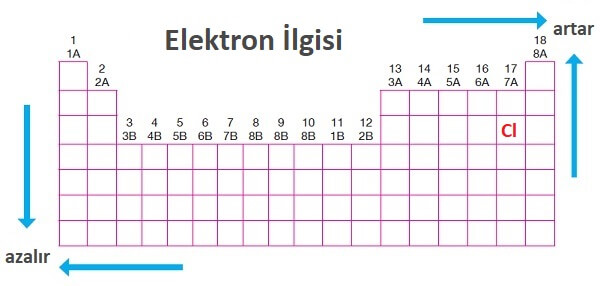
Periyodik Sistemde Elektron İlgisi
- Yukarı ve sağa doğru gidildikçe elektron ilgisi artar.
- En cömert atom Klor atomudur (Cl).
Periyodik Özellikler
4) Elektronegatiflik (En) Eğilimi
Elektronegatiflik (En) Nedir?
- Tanım: Bir atomun, kovalent bağ elektronlarını kendine doğru çekme gücüne elektronegatiflik (elektronegativite veya eksiçekerlik) denir.
- Ametallerin daha üstün olduğu bir özelliktir.
- Elektronegativitesi en yüksek olan atom Flor (F) atomudur.
- Flor atomunun elektornegatiflik değeri keyfi olarak 4.0 kabul edilmiştir.
- Diğer atomların elektronegatiflik değeri F’ye oranla hesaplanmıştır.
- Periyodik sistemde elektronegatifliği en büyük üç element sırası ile flor (F), oksijen (O) ve azottur (N).
- Elektronegatiflik değerlerinin bir birimi yoktur.
- Soygazların elektronegatiflik değerleri de çok düşüktür.
Periyodik Özellikler
4) Elektronegatiflik (EN) Eğilimi
Periyodik Sistemde Elektronegatiflik
- Yukarı ve sağa doğru gidildikçe elektron ilgisi artar.
- En çekici atom Flor atomudur (F).
- İki atom arasındaki elektronegatiflik farkı ne kadar fazla ise, bağları o kadar çok iyonik karakterli olur.

Periyodik Özellikler
5) Metalik – Ametalik Aktiflik
Metalik-Ametalik Özellik Nedir?
- Başlıca metalik özellikler şunlardır:
- Elektrik iletkenliği,
- Parlak yüzey,
- Elektron verme eğilimi,
- İyonik ve metalik bağ kurabilme yeteneği,
- Şekil alabilme
- Bu özellikleri daha iyi gösteren elementlerin metalik aktifliği daha yüksektir.
- Başlıca ametalik özellikler şunlardır:
- Elektrik yalıtkanlığı,
- Mat yüzey,
- Elektron alma eğilimi,
- Kovalent bağ kurabilme yeteneği
- Bu özellikleri daha iyi gösteren elementlerin ametalik aktifliği daha yüksektir.
Periyodik Özellikler
5) Metalik – Ametalik Aktiflik
Periyodik Sistemde Metalik-Ametalik Aktiflik
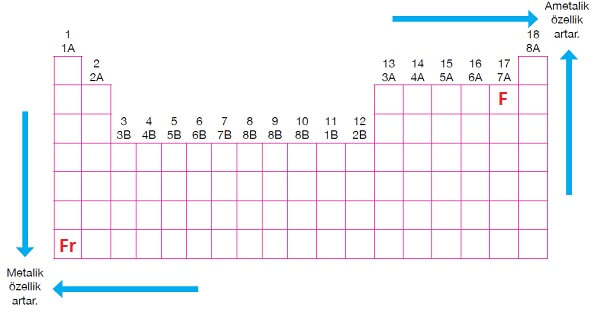
- Yukarı ve sağa doğru gidildikçe ametalik özellik artar.
- En iyi ametal Flor atomudur (F).
- Aşağı ve sola doğru gidildikçe metalik özellik artar.
- En iyi metal Fransiyum atomudur (Fr).
Periyodik Özellikler
6) Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
Oksit Bileşikleri Nedir?
- Bir elementin oksijen ile yaptığı bileşiklere (OF2 hariç) oksit bileşikleri denir.
- Bazı oksit bileşikleri:
- CaO (Kalsiyum oksit)
- Na2O (Sodyum oksit)
- CO2 (Karbon dioksit)
- SO2 (Kükürt dioksit)
- N2O5 (Diazot pentaoksit)
- Oksit bileşiklerinde, oksijenin yükü genellikle -2 olur.
Oksit Bileşiklerinin Sınıflandırılması
- Asidik oksit
- Bazik oksit
- Nötür oksit
- Amfoter oksit
Periyodik Özellikler
6) Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
I. Asidik Oksit Nedir?
- Ametallerin oksijence zengin olan oksitleri asidik oksittir.
- Bazı asidik oksit bileşikleri:
- CO2 (Karbon dioksit)
- SO2 (Kükürt dioksit)
- N2O5 (Diazot pentaoksit)
Asidik Oksitlerin Özellikleri Nelerdir?
- “Susuz asitler” olarak da bilinirler, suyla tepkimeye girerek, asitleri oluştururlar.
- Asitler gibi davranırlar:
- Bazlarla tepkimeye girerek tuz ve su oluştururlar.
- Asitler gibi suya H+ iyonu verirler.
- Bazı asidik oksitlerin suda çözünme tepkimeleri şöyledir:
CO2(g) + H2O(s) → 2H+(suda) + CO32-(suda)
SO2(g) + H2O(s) → 2H+(suda) + SO32-(suda)
N2O5(g) + H2O(s) → 2H+(suda) + 2NO3–(suda)
Periyodik Özellikler
6) Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
II. Bazik Oksit Nedir?
- Metallerin oksitleri bazik oksitlerdir.
- Bazı bazik oksit bileşikleri:
- CaO (Kalsiyum oksit)
- K2O (Potasyum oksit)
- Na2O (Sodyum oksit)
Bazik Oksitlerin Özellikleri Nelerdir?
- “Susuz bazlar” da denir, suyla tepkimeye girerek bazları oluştururlar.
- Bazlar gibi davranırlar:
- Asitlerle tepkimeye girerek tuz ve su oluştururlar.
- Çözündüklerinde suya OH– iyonu verirler:
CaO(k) + H2O(s) → Ca2+(suda) + 2OH–(suda)
Na2O(k) + H2O(s) → 2Na+(suda) + 2OH–(suda)
Periyodik Özellikler
6) Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
III. Nötür Oksit Nedir?
- Ametallerin oksijence zengin olmayan oksitleri nötür oksitlerdir.
- Bazı nötür oksit bileşikleri:
- CO (Karbon monoksit)
- NO (Azot monoksit)
- N2O (Diazot monoksit)
Nötür Oksitlerin Özellikleri Nelerdir?
- Asit ya da baz özelliği göstermezler.
- Asit ya da bazlarla ya da suyla tepkimeye girmezler.
Periyodik Özellikler
6) Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
IV. Amfoter Oksit Nedir?
- Amfoter metallerin oksitleri, amfoter oksitlerdir.
- Amfoter metaller şunlardır:
- Al (Alüminyum)
- Cr (Krom)
- Pb (Kurşun)
- Sn (Kalay)
- Zn (Çinko)
- Be (Berilyum)
Amfoter Oksit Örnekleri:
- Amfoter oksitler şunlardır:
- Al2O3 (Alüminyum oksit)
- Cr2O3 (Krom -III- oksit)
- PbO2 (Kurşun -IV- oksit)
- SnO2 (Kalay -IV- oksit)
- ZnO (Çinko oksit)
- BeO (Berilyum oksit)
Amfoter Oksitlerin Özellikleri Nelerdir?
- Hem asitlerle hem de bazlarla tepkimeye girerler.
- Amfoter oksitler; suyla tepkimeye girmezler.
Periyodik Özellikler
6) Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
Hidroksit Bileşikleri Nedir?
- OH– iyonunun bileşiklerine hidroksit bileşikleri denir.
- Bazı hidroksit bileşikleri şunlardır:
- NaOH : Sodyum hidroksit
- KOH : Potasyum hidroksit
- Mg(OH)2 : Magnezyum hidroksit
- Be(OH)2 : Berilyum hidroksit
- Al(OH)3 : Alüminyum hidroksit
Hidroksit Bileşiklerinin Özellikleri Nelerdir?
- 1A ve 2A grubu metallerinin hidroksit bileşikleri kuvvetli bazlardır.
- 1A : H, Li, Na, K, Rb, Cs, Fr
- 2A : Be, Mg, Ca, Sr, Ba, Ra
- Hidroksit bileşiklerindeki metal ne kadar aktif ise, bileşik o kadar kuvvetli bir bazdır.
- Fe(OH)2, Cu(OH)2 gibi B grubu metallerinin hidroksit bileşikleri, genellikle zayıf bazlardır.
Periyodik Özellikler
6) Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
Periyodik Sistemde Asidik/Bazik Özellik
Bazik Özellik
- Bir madde suya ne kadar çok OH– (hidroksit) iyonu verebiliyorsa bazik özelliği o kadar güçlüdür.
- Aynı grupta aşağıda doğru inildikçe, oksit ve hidroksit bileşiklerinin bazik özelliği artar.
- Bazik özelliğin arttığı yönde asidik özellik azalır.
- Periyodik tabloda, metallere doğru bazik karakter artar.
Asidik Özellik
- Bir madde suya ne kadar çok H+ (hidrojen) iyonu verebiliyorsa asidik özelliği o kadar güçlüdür.
- Halojenlerin Hidrojenli bileşikleri asidiktir: HF, HCl, HBr, HI
- Halojenlerde, aşağı doğru inildikçe asidik kuvvet artar:
- Asitlik: HF < HCl < HBr < HI
- H bileşiklerinde, oksijen sayısı arttıkça, bileşiğin asidik karakteri artar:
- Asitlik: HClO < HClO2 < HClO3 < HClO4
- Periyodik tabloda ametallere doğru asidik karakter artar.

Modern Atom Teorisi
III. Bölüm
(Periyodik Özellikler)
Bitti 🙁