Kimyasal Tepkimelerde Denge → 1. Bölüm
İçindekiler
- 1. Bölüm: Kimyasal Denge
- Denge Tepkimesi Nedir?
- Denge Tepkimesi Nedir?
- Denge Anı
- Kc – Derişimler Cinsinden Denge Sabiti
- Kc Bağıntısının Türetilmesi
- Kc – Derişimler Cinsinden Denge Sabiti
- Kc – Derişimler Cinsinden Denge Sabiti
- Kc – Derişimler Cinsinden Denge Sabiti
- Kc – Derişimler Cinsinden Denge Sabiti
- Fiziksel ve Kimyasal Denge
- Homojen ve Heterojen Denge
- Homojen ve Heterojen Denge
- Niçin Denge?
- Kp – Kısmi Basınçlar Cinsinden Denge Sabiti
- Kp – Kısmi Basınçlar Cinsinden Denge Sabiti
- Kp – Kısmi Basınçlar Cinsinden Denge Sabiti
- Kc ile Kp Arasındaki İlişki
- Kp = Kc.(R.T)Δn
- Kc ile Kp Arasındaki İlişki
- Kc ile Kp Arasındaki İlişki
- Denge Kurulmuş Mu? (Yalancı Denge Sabiti (Qc))
- Denge Kurulmuş Mu? (Yalancı Denge Sabiti (Qc))
- Tepkime Denklemi ile Denge Sabiti Arasındaki İlişki
- Tepkime Denklemi ile Denge Sabiti Arasındaki İlişki
DERS
AYT Kimya
Kimya 11
KONU
ÜNİTE VI
KİMYASAL TEPKİMELERDE DENGE
I. Bölüm

KİMYASAL TEPKİMELERDE DENGE
Ünitenin 3 bölümü vardır:
1- Kimyasal Denge
2- Dengeyi Etkileyen Faktörler
3- Sulu Çözelti Dengeleri
Yıllara Göre Soru Sayısı (AYT)
| Yıl | 2022 | 2021 | 2020 | 2019 | 2018 |
| Soru Sayısı | 2 | 2 | 2 | 2 | 1 |
1. Bölüm: Kimyasal Denge
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Gerekli Bilgiler:
- Kimyasal Tepkimelerde Enerji
- Kimyasal Tepkimelerde Hız
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- Denge Tepkimesi Nedir?
- Kc Bağıntısı
- Fiziksel ve Kimyasal Denge
- Homojen ve Heterojen Denge
- Niçin Denge?
- Kp Bağıntısı
- Denge Kurulmuş Mu? (Yalancı Denge Sabiti (Qc))
- Tepkime Denklemi ile Denge Sabiti Arasındaki İlişki
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Denge Tepkimesi Nedir?
- Denge tepkimeleri çift yönlü gerçekleşir:
- Denge tepkimeleri, “tersinir tepkimeler” olarak da adlandırılır.
- Bir tepkimenin, denge kurabilmesi için, kapalı bir sistemde gerçekleşmesi gerekir.
- Denge tepkimelerinde, tepkimeye giren maddeler hiç bir zaman bitmez.
- Bu yüzden; tepkime verimi hiç bir zaman %100 olmaz.
- Denge tepkimeleri, bir yandan dolan diğer yandan boşalan bir havuza benzer.
Dengede Tepkime Oku:
⇄
↔
⇌
Denge Tepkimesi Örneği:
- Aşağıda; bazı denge tepkimelerine ait tepkime denklemleri verilmiştir:
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
- 4NO2 + O2 ⇌ 2N2O5
Denge Tepkimesi Nedir?
Örnek:
Örnek bir denge tepkimesi:
A + B ⇌ C + D
- Bu denge tepkimesi için:
- İleri tepkimede A ve B maddeleri, C ve D maddelerine dönüşür:
A + B → C + D - Geri tepkimede, C ve D maddeleri, A ve B’ye dönüşür:
C + D → A + B
- İleri tepkimede A ve B maddeleri, C ve D maddelerine dönüşür:
Örnek:
Kimyasal tepkimelerde denge için aşağıda verilenlerden hangisi doğru değildir?
A) Tepkime ileri ve geri yönde gerçekleşir.
B) Tepkime verimi %100’dür.
C) Tersinir tepkimelerdir.
D) Tepkime oku çift yöne bakar.
E) Bir yandan ürünler oluşurken diğer yandan girenler geri oluşur.
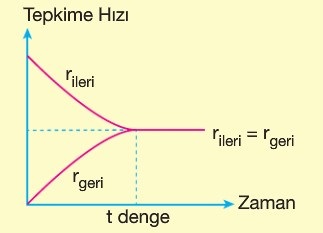
Denge Anı
- Denge tepkimelerinde, başlangıçta, ileri tepkime daha hızlı, geri tepkime daha yavaştır.
- Zamanla, ileri tepkime yavaşlar; geri tepkime hızlanır.
- Belli bir anda, her iki yöndeki tepkimenin de hızı eşitlenir.
- Bu eşitliğin sağlandığı ana, denge anı denir.
- Denge anının temel özellikleri şunlardır:
- Dengedeki bir tepkime durmuş gibi görünür.
- Denge kurulduktan sonra, tepkimede, gözle görünen bir olay gerçekleşmez. Ama aslında; tepkime her iki yönde de eşit hızda gerçekleşmeye devam ediyordur.
- Yani; denge anında; makro olaylar durur, mikro olaylar devam eder.
- Açık sistemlerde (kaplarda) denge kurulamaz.
Kc – Derişimler Cinsinden Denge Sabiti
- Her denge tepkimesinin, bir denge sabiti vardır.
- Denge anındaki derişimler yardımı ile hesaplanan denge sabitine “Kc” denir.
- “Kc“, “Derişimler Cinsinden Denge Sabiti” olarak adlandırılır.
- Kc‘yi hesaplamanın iki yolu vardır:
- İleri ve geri tepkimenin hız sabitlerinden:

- Denge bağıntısı ile:
- İleri ve geri tepkimenin hız sabitlerinden:

- Köşeli parantez, maddenin Molaritesi demektir.
- Kc değeri, denge anındaki Molariteler ile hesaplanır.
Örnek:
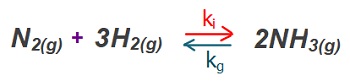
Yukarıdaki tepkimenin denge bağıntısı şöyledir:

Kc Bağıntısının Türetilmesi
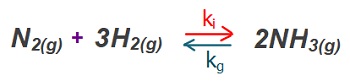
tepkimesi için:
- İleri tepkime:

- İleri tepkimenin hızı:
rileri = ki[N2][H2]3
(ki = ileri tepkimenin hız sabitidir.)
- İleri tepkimenin hızı:
- Geri tepkime:

- Geri tepkimenin hızı:
rgeri = kg[NH3]2
(kg = Geri tepkimenin hız sabitidir.)
- Geri tepkimenin hızı:
- Denge kurulduğunda:
rileri = rgeri
olduğundan
ki[N2][H2]3 = kg[NH3]2
- Hız sabitlerini sol tarafa toplarsak:
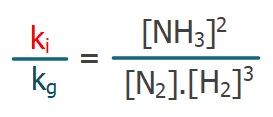
- Bu eşitliğin her iki tarafı da Kc değerini verir:

veya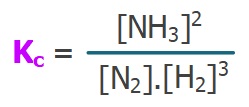
Kc – Derişimler Cinsinden Denge Sabiti
Katı ve sıvılar Kc bağıntısına giremez; gazlar ve suda çözünen maddeler girer,
Örnek:
I) N2(g) + 3H2(g) ⇌ 2NH3(g)
II) 4NO2(g) + O2(g) ⇌ 2N2O5(g)
III) Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
IV) CaCO3(k) ⇌ CaO(k) + CO2(g)
Yukarıda verilen tepkimelerin derişimler türünden denge bağıntılarını (Kc) yazınız.
Kc – Derişimler Cinsinden Denge Sabiti
Kc sabiti, denge kurulduktan sonraki derişim değerleri ile hesaplanır.
Örnek:
N2(g) + 3H2(g) ⇌ 2NH3(g) tepkimesi dengede iken, kapta 4M N2 gazı, 1M H2 gazı ve 3M NH3 gazı vardır.
Buna göre, bu koşullarda, bu tepkimenin Kc değeri kaçtır?
Kc – Derişimler Cinsinden Denge Sabiti
Örnek:
H2(g) + Cl2(g) ⇌ 2HCl(g) Kc = 4
Yukarıdaki tepkimenin, 20oC’de denge sabiti Kc = 4’tür. Tepkime, 2’şer Molar H2 ve Cl2 gazları ile başlamıştır.
Buna göre, aynı koşullarda tepkime dengeye ulaştığında, ürün ve girenlerin derişimlerini hesaplayınız.
Kc – Derişimler Cinsinden Denge Sabiti
Örnek:
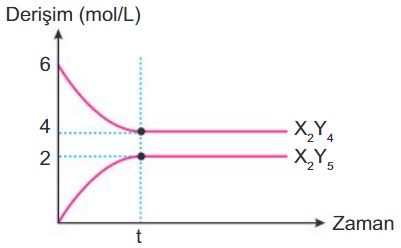
Yukarıdaki derişim-zaman grafiği aşağıdaki tepkimeye aittir.
2X2Y4(g) + Y2(g) ⇌ 2X2Y5(g)
Başlangıçta reaktifler eşit derişimde ise, bu tepkimenin, bu koşullardaki Kc değeri kaçtır?
Fiziksel ve Kimyasal Denge
- Denge tepkimesi, fiziksel bir tepkime ise, kurulan denge fiziksel dengedir.
- Denge tepkimesi, kimyasal bir tepkime ise, kurulan denge kimyasal dengedir.
- Fiziksel tepkimeleri hatırlayalım;
- Suda çözünme tepkimeleri
- Çökelme tepkimeleri
- Hal değişim tepkimeleri (erime, donma, kaynama, yoğunlaşma…)
- Kimyasal tepkimeleri hatırlayalım:
- Asit-baz tepkimeleri
- Yanma tepkimeleri
- Metal-asit tepkimeleri
- …
- Fiziksel denge örnekleri:
- H2O(s) ⇌ H2O(g)
- Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
- NaCl(k) ⇌ Na+(suda) + Cl–(suda)
- Kimyasal denge örnekleri:
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- 4NO2 + O2 ⇌ 2N2O5
Homojen ve Heterojen Denge
- Dengedeki bir tepkimede, ürünler ve girenler hep birlikte, homojen bir karışım oluşturuyorsa, tepkimeye, “homojen denge tepkimesi” denir.
- Gazlar, arasında gerçekleşen denge tepkimeleri, her zaman homojen denge tepkimeleridir.
- Suda çözünen maddelerin verdiği denge tepkimeleri, homojen denge tepkimeleridir.
- Dengedeki bir tepkimede, ürünler ve girenler hep birlikte, heterojen bir karışım oluşturuyorsa, tepkimeye, “heterojen denge tepkimesi” denir.
Homojen Denge Örnekleri
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- 4NO2(g) + O2(g) ⇌ 2N2O5(g)
- HF(suda) + H2O(s) ⇌ H3O+(suda) + F–(suda)
Heterojen Denge Örnekleri
- Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
- NaCl(k) ⇌ Na+(suda) + Cl–(suda)
- CaCO3(k) ⇌ CaO(k) + CO2(g)
- H2O(s) ⇌ H2O(g)
Homojen ve Heterojen Denge
Örnek:
I) N2(g) + 3H2(g) ⇌ 2NH3(g)
II) HF(suda) ⇌ H+(suda) + F–(suda)
III) H2O(s) ⇌ H2O(k)
Yukarıda verilen tepkimeler ile ilgili olarak aşağıdaki ifadelerden hangisi yanıştır?
A) I. tepkime bir kimyasal denge tepkimesidir.
B) Her üçü de homojen denge tepkimeleridir.
C) II. tepkime bir asidin çözünme dengesidir.
D) III. tepkimede, bir yandan donma gerçekleşirken diğer yandan erime gerçekleşmektedir.
E) II. tepkimede HF asidi hem iyonal hem de moleküler çözünür.
Niçin Denge?
- Maddeler 2 şey ister. Bu 2 istek şöyle ifade edilir:
- Maksimum düzensizlik eğilimi:
- Hep daha düzensiz olma isteğidir.
- Minimum enerji eğilimi:
- Hep daha az enerjiye sahip olma isteğidir.
- Maksimum düzensizlik eğilimi:
- Kimyasal tepkimelerde bu eğilimler şöyle yorumlanır:
- Maksimum düzensizlik eğilimi tepkimenin, maddelerin daha düzensiz olduğu tarafa gerçekleşmesini ister.
- Minimum enerji eğilimi ise tepkimenin, enerjinin daha az olduğu tarafa (ısının olduğu tarafa) gerçekleşmesini ister.
- Bu iki eğilim zıt yönlerde ise tepkime bir denge tepkimesi şeklinde gerçekleşir.
Örnek:
N2(g) + 3H2(g) → 2NH3(g) + ısı
Tepkimesinde;
- Minimum enerji eğilimi,
- tepkimenin ürünler yönünde
- Maksimum düzensizlik eğilimi ise,
- girenler yönünde gerçekleşmesini ister.
Bu yüzden bu tepkimeden, bir denge tepkimesi şeklinde yürümesini bekleriz.
Kp – Kısmi Basınçlar Cinsinden Denge Sabiti
- Kp; tepkimedeki gazların kısmi basınçları (P) ile hesaplanan bir denge sabitidir.
- Kp bağıntısına, gaz olmayan maddeler giremez.
- Kp bağıntısı aşağıdaki şablon ile hesaplanır:

Örnek:
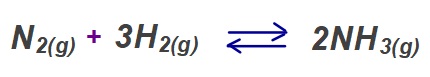
Yukarıda verilen tepkimenin Kp bağıntısı şöyledir:
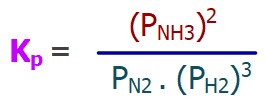
Kp – Kısmi Basınçlar Cinsinden Denge Sabiti
Kp bağıntısında sadece gazlar yer alır.
Örnek:
I) 2NH3(g) ⇌ N2(g) + 3H2(g)
II) 4NO2(g) + O2(g) ⇌ 2N2O5(g)
III) CaCO3(k) ⇌ CaO(k) + CO2(g)
IV) 2A(suda) + 3B(g) ⇌ 2C(suda) + D(s)
Yukarıda verilen tepkimelerin, kısmi basınçlar cinsinden denge bağıntılarını (Kp) yazınız.
Kp – Kısmi Basınçlar Cinsinden Denge Sabiti
Örnek:
2CO2(g) ⇌ 2CO(g) + O2(g)
Kapalı bir kaba, sabit bir sıcaklıkta, 1,2 atm basınç yapan CO2 gazı konuluyor ve yukarıdaki tepkime gerçekleştiriliyor.
Sistem dengeye ulaştığında kaptaki toplam basınç 1,6 atm olduğuna göre, bu şartlarda bu tepkimenin kısmi basınçlar cinsinden denge sabiti (Kp) kaçtır?
Kc ile Kp Arasındaki İlişki
Kp = Kc.(R.T)Δn
- Kp : Kısmi basınçlar cinsinden denge sabiti
- Kc : Derişimler cinsinden denge sabiti
- R : İdeal gaz sabiti

- T: Mutlak sıcaklık
- T = t + 273
- Δn = Ürünlerdeki gazların toplam katsayısı – Girenlerdeki gazların toplam katsayısı
Örnek:
Aşağıda bazı tepkimeler ve Δn değerleri verilmiştir:
- C3H8(g) + 5O2(g) ⇌ 3CO2(g) + 4H2O(g)
- Δn = 7 – 6 = 1
- H2(g) + Cl2(g) ⇌ 2HCl(g)
- Δn = 2 – 2 = 0
Kc ile Kp Arasındaki İlişki
Örnek:
I) N2(g) + 3H2(g) ⇌ 2NH3(g)
II) C3H8(g) + 5O2(g) ⇌ 3CO2(g) + 4H2O(g)
III) H2(g) + Cl2(g) ⇌ 2HCl(g)
Yukarda verilen tepkimelerin Kp ve Kc değerleri arasındaki eşitliği bulunuz.
Kc ile Kp Arasındaki İlişki
Örnek:

Denge Kurulmuş Mu? (Yalancı Denge Sabiti (Qc))
- Herhangi bir anda tepkimenin dengede olup olmadığını anlamak mümkündür. Bunun için:
- O anda, tepkimedeki maddelerin derişimleri denge bağıntısında yerine yazılır.
- Bulunan sonuca Qc (yalancı denge sabiti) denir.
- Qc ile tepkimenin Kc değeri karşılaştırılır.
- Aşağıda bu karşılaştırmanın nasıl yapılacağı verilmiştir:
- Qc = Kc olursa:
- Tepkime dengededir.
- Qc > Kc olursa:
- Ürünler olması gerekenden fazladır.
- Tepkime girenler yönüne (geriye/sola) kayarak dengeye ulaşır.
- Qc < Kc olursa:
- Girenler olması gerekenden fazladır.
- Tepkime ürünler yönüne (ileriye/sağa) kayarak dengeye ulaşır.
- Qc = Kc olursa:
Denge Kurulmuş Mu? (Yalancı Denge Sabiti (Qc))
Örnek:
N2O4(g) ⇌ 2NO2(g)
Yukarıda verilen tepkimenin, belirli bir sıcaklıkta, Kc değeri 5,1 olarak veriliyor. Aynı sıcaklıkta, tepkime kabına, 2M N2O4 gazı ile 4M NO2 gazı konuluyor.
Buna göre, bu tepkimenin yönü için ne söylenebilir?
Tepkime Denklemi ile Denge Sabiti Arasındaki İlişki
- Tepkime bir sayı ile genişletilirse, bu sayı, Kc’nin üssü olur.
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- tepkimesinde Kc = 5 ise
- 2N2(g) + 6H2(g) ⇌ 4NH3(g)
- tepkimesinde Kc = 52 = 25 olur
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- Tepkime ters çevrilirse, Kc’nin çarpmaya göre tersi alınır.
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- tepkimesinde Kc = 5 ise
- 2NH3(g) ⇌ N2(g) + 3H2(g)
- tepkimesinde Kc = 1/5 olur.
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- Tepkimeler toplanırsa, Kc değerleri çarpılır.
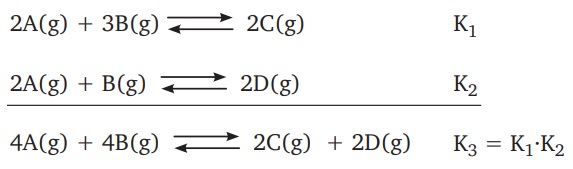
Tepkime Denklemi ile Denge Sabiti Arasındaki İlişki
Örnek:
N2(g) + 3H2(g) ⇌ 2NH3(g) Kc = 16
Yukarıda verilen tepkime ile aynı koşullarda gerçekleşen aşağıdaki tepkimenin Kc değerini hesaplayınız.
NH3(g) ⇌ 1/2N2(g) + 3/2H2(g)

Kimyasal Tepkimelerde Denge
I. Bölüm
Kimyasal Denge
Bitti 🙁