Gazlar → 5. Bölüm
İçindekiler
- 5. Bölüm: Gerçek Gazlar
- Gerçek Gaz Nedir?
- Gerçek Gazlar Ne Zaman İdeale Daha Yakın Davranır?
- Gerçek Gazların İdeallikten Sapmaları
- Faz Diyagramları (Basınç-Sıcaklık Grafiği)
- Faz Diyagramından Maddenin Fiziksel Halini Bulma
- Gerçek Gazlar
- Gerçek Gazlar
- Faz Diyagramında Hal Değişim Sıcaklığı – Dış Basınç İlişkilisini Görme
- Suyun Faz Diyagramı
- Gaz – Buhar – Kritik Sıcaklık
- Joule-Thomson Olayı
- Joule – Thomson Olayı
- Soğutucu Akışkanlar
- Gerçek Gazlar
- Çevremizdeki Joule-Thomson Olayları
DERS
AYT Kimya
Kimya 11
KONU
ÜNİTE II
GAZLAR
V. Bölüm
5. Bölüm: Gerçek Gazlar
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Gerekli Bilgiler:
- Mol Kavramı
- Kimyasal Tepkimeler
- Kimyasal Tepkimelerde Hesaplamalar
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- Gerçek Gazlar
- Gerçek – İdeal Gaz Farkı
- Faz Diyagramları
- Joule-Thomson Olayı
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Gerçek Gaz Nedir?
- Gerçek hayatta, ideal gaz yoktur, “gerçek gazlar” vardır.
İdeal Gaz
- Kimyasal türler esnek çarpışmalar yapar.
- Kimyasal türlerinin hacmi yok kabul edilir.
- Kimyasal türleri arasında etkileşim yok kabul edilir.
Gerçek Gaz
- Esnek çarpışma yoktur.
- Kimyasal türlerinin de bir hacmi vardır ve bu hacme öz hacim denir.
- Gerçek gaz, idealinden daha fazla hacim kaplar.
- Kimyasal türleri arasında az da olsa etkileşim vardır.
- Gerçek gazın basıncı idealinden daha azdır.
Gerçek Gazlar Ne Zaman İdeale Daha Yakın Davranır?
- Aşağıdaki koşullarda, gerçek gazlar ideal gaza daha yakın davranır:
- Yüksek sıcaklık
- Düşük basınç
- Düşük mol ağırlığı (MA)
- Kimyasal türleri apolar olanlar daha ideal davranırlar.
Örnek:
Aşağıdaki gazlardan hangisi ideale daha yakın davranır?
A) 100 oC’de ve 4 atm basınç yapan He gazı
B) 200 oC’de ve 4 atm basınç yapan He gazı
C) 300 oC’de ve 4 atm basınç yapan He gazı
D) 400 oC’de ve 2 atm basınç yapan He gazı
E) 400 oC’de ve 4 atm basınç yapan He gazı
Gerçek Gazların İdeallikten Sapmaları
P.V = n.R.T den mol sayısın (n) çekersek formül şöyle olur:

Bir ideal gaz 1 mol ise P.V / R.T değeri her zaman 1 çıkar:
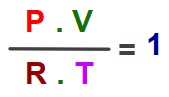
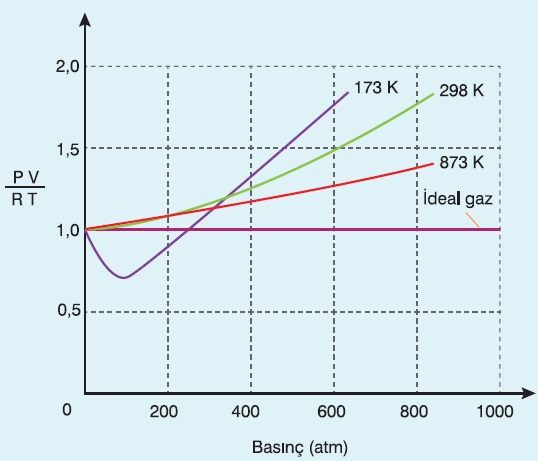
- Basınç arttıkça ideallikten uzaklaşılır:

- Sıcaklık arttıkça idealliğe yaklaşılır:
Faz Diyagramları (Basınç-Sıcaklık Grafiği)
- Her maddenin bir faz diyagramı vardır.
- Maddelerin basınç-sıcaklık grafikleridir.
- Bir maddenin, basınç ve sıcaklık değerine göre katı–sıvı–gaz hallerinden hangisinde oluğunu görmemizi sağlar.
- Bir maddenin hangi dış basınçta iken kaç derecede hal değiştirdiğini de görebiliriz.
- Özensiz çizilmiş bir “Y” harfine benzerler.

Faz Diyagramından Maddenin Fiziksel Halini Bulma
- Bütün faz diyagramlarında 3 tane faz bölgesi vardır.
- Faz bölgeleri, maddelerin katı-sıvı-gaz hallerinde oldukları sıcaklık ve basınç değerlerini gösterir.
- Faz bölgelerinin sırası her zaman aynıdır ve yandaki gibidir.
- Faz bölgeleri arasındaki çizgiler faz sınırlarıdır ve hal değişim noktalarını gösterir.
- Grafikteki A noktası üçlü nokta olarak bilinir.
- Üçlü noktada madde hem katı hem sıvı hem de gaz halindedir.

Gerçek Gazlar
Örnek:

Faz diyagramı verilen CO2‘in aşağıdaki koşullardaki fiziksel halini bulunuz.
- 10 atm basınç ve -78,5 oC sıcaklıkta
- 10 atm basınç ve -20 oC sıcaklıkta
- 1 atm basınç ve -20 oC sıcaklıkta
Gerçek Gazlar
Örnek:

CO2‘e ait faz diyagramı verilmiştir.
Buna göre, grafikte verilen A, B, C, D ve E noktalarının anlamları nedir?
Faz Diyagramında Hal Değişim Sıcaklığı – Dış Basınç İlişkilisini Görme

- Faz diyagramlarnda, faz sınırlarına bakarak şunları görebiliriz:
- Bir maddenin, erime noktası, dış basınç arttıkça artar, azaldıkça azalır.
- Bir maddenin, kaynama noktası, dış basınç arttıkça artar, azaldıkça azalır.
- Bir maddenin, süblimleşme sıcaklığı, dış basınç arttıkça artar.
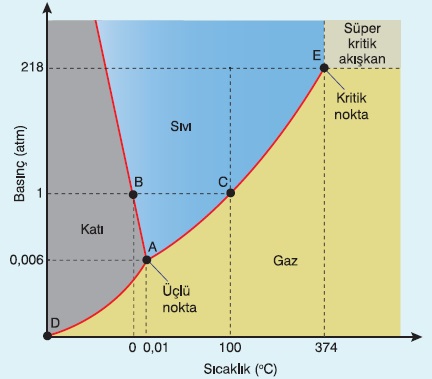
Suyun Faz Diyagramı
- Diğer maddelerden farklı olarak; suyun donma sıcaklığı, dış basınç arttıkça azalır.


Gaz – Buhar – Kritik Sıcaklık
- Bir gaz sıkıştırıldığında sıvılaşabiliyorsa buhar olarak adlandırılabilir.
- Gazlar kritik sıcaklıktan, sonra basınç ile sıkışıp sıvılaşabilme özelliklerini kaybederler.
- Bir gazın, sıkışıp sıvılaşma özelliğini koruyabildiği, son sıcaklık ve basınç değerine kritik sıcaklık denir.
- Bir gazın süper kritik akışkan olarak davrandığı en düşük sıcaklık ve basınç değerine kritik nokta denir.
- Suyun faz diyagramı ve kritik noktası:
Joule-Thomson Olayı

- Gazlardan (aslında buharlardan), buz dolabı veya klima yapabilmemizi sağlayan olaydır.
- Joule-Thomson olayında:
- Gaz, ortasındaki bir engelle ikiye bölünmüş, kapalı bir kabın, bir kısmından itilerek diğer kısmına geçer. Tabi; kabın diğer kısmına geçebileceği tek yol, kabı ikiye bölen engeldeki küçük bir delik ya da deliklerdir.
- Karşıya geçerken gazın sıcaklığı düşer ya da yükselir.
- Sıcaklık değişmiyorsa, Joule-Thomson olayı yok demektir.
- Bu durumda gaz ideale daha yakın bir gazdır.
- Jolue-Thomson olayının sebebi, kimyasal türler arasındaki zayıf etkileşimlerdir.
Joule – Thomson Olayı
Soğutucu Akışkanlar
- Joule-Thomson olayında sıcaklığı düşen gazlara, soğutucu akışkan denir.
- Soğutucu akışkan örnekleri;
- NH3 (Amonyak)
- Freon (CCl2F2)
- Puron (Kütlece %50 diklorometan ve pentafloretan)
- Amonyak ve Freon gazları çevre ve sağlık ve çevre açısından sakıncalı oldukları için; günümüzde Puron gazı soğutucu akışkan olarak kullanılmaktadır.
- İyi bir soğutucu akışkanın:
- Kritik sıcaklığı yüksek, kaynama noktasına düşük olmalıdır.
- Oda koşullarında buhar halinde olmalıdır.
- Çevreye zarar vermemelidir.
- Daha az enerji tüketmelidir.
- Ucuz ve kolay temin edilebilmelidir.
- Yanıcı ve zehirli olmamalı, kimyasal yönden metallerle tepkimeye girmemelidir.
- Uygulanabilir basınç altında buharlaşmalı ve sıvılaşmalıdır.
Gerçek Gazlar
Örnek:
Aşağıdaki tabloda bazı maddelerin normal kaynama noktaları ve kritik sıcaklıkları verilmiştir.
| Madde | Kaynama Sıcaklığı (oC) | Kritik Sıcaklığı (oC) |
|---|---|---|
| X | -35,6 | 145 |
| Y | 60 | 322 |
| Z | 101 | 384,5 |
Buna göre bu maddeler için aşağıdakilerden hangisi yanlıştır?
A) X soğutucu akışkan olarak kullanılabilir.
B) Y, oda sıcaklığında gaz haldedir.
C) Z, 384,5 derecenin üzerinde sıkıştırılıp sıvılaştırılamaz.
D) Z maddesinin kimyasal türleri arasındaki etkileşim daha güçlüdür.
E) X 120 derecede, sıkışıp sıvılaşabilir.
Çevremizdeki Joule-Thomson Olayları

Bir el pompası ile bisiklet tekerleği şişiren herkes, zamanla pompanın ısındığını bilir.

Bir çakmağın gazını, valfine kalem batırarak boşaltan herkes, bir süre sonra kalemin üzerinin kırağılandığını ve soğuduğunu bilir.

Sıcaklığın düştüğü Joule-Thomson olayına; buzdolapları ve klimalar da örnek olarak verilebilir.
- Havadan; Azot ve Oksijen gazlarının elde edilmesi işleminde de, Joule-Thomson olayı sayesinde havanın sıcaklığı, -200 oC ye kadar düşürülür.

Gazlar
V. Bölüm
(Gerçek Gazlar)
Bitti 🙁