Gazlar → 2. Bölüm
İçindekiler
DERS
AYT Kimya
Kimya 11
KONU
ÜNİTE II
GAZLAR
II. Bölüm
2. Bölüm: İdeal Gaz Yasası
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Gerekli Bilgiler:
- Mol Kavramı
- Kimyasal Tepkimeler
- Kimyasal Tepkimelerde Hesaplamalar
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- İdeal Gaz Yasası
- İdeal Gaz Yasası
- Gazların Yoğunluğu
* Konu anlatımı, örneklerle zenginleştirilmiştir.
İdeal Gaz Yasası
İdeal Gaz Nedir?
- İdeal gazlar şu özellikleri taşır:
- Kimyasal türlerinin hacimleri yok kabul edilir.
- Kimyasal türleri esnek çarpışmalar yapar.
- Kimyasal türleri arasında etkileşim yok kabul edilir.
- İdeal Gaz Yasası‘na uyarlar.
- Çevremizde ideal gaz yoktur, hepsi gerçek gazlardır.
Gerçek Gazlar Ne Zaman İdeale Yakın Davranırlar?
- Molekül ağırlığı daha küçük,
- Sıcaklığı daha yüksek,
- Basıncı daha düşük olan gazlar ideal gaza daha yakın davranır.
Sorulardaki gazlar aksi belirtilmediği müddetçe ideal gaz kabul edilir.
Örnek:
| Gaz | Sıcaklık | Basınç |
| H2 | 27 oC | 76 cmHg |
| CH4 | 300 K | 2 atm |
| O2 | 200 K | 1520 Torr |
Verilen tabloya göre ideal gaza en yakın davranan gaz hangisidir?
(H: 1 g/mol, C:12 g/mol, O:16 g/mol)
İdeal Gaz Yasası
İdeal Gaz Yasası Nedir?
- İdeal Gaz Yasası: “İdeal Gaz Denklemi” olarak da bilinir.
- İdeal gaz denkelmi şudur:
P.V = n.R.T
- P: Gaz basıncıdır (atm).
- V: Gaz hacmidir (L).
- n: Gazın mol sayısıdır (mol).
- T: Gazın sıcaklığıdır (Kelvin (K))
- R: İdeal Gaz Sabiti

Örnek:
0 oC sıcaklıkta, 11,2 Litrelik bir kapta bulunan 2 mol He gazının, kaba uyguladığı basıncı hesaplayınız.
İdeal Gaz Yasası
Örnek:
İdeal gaz sabitinin (R) birimini bulunuz?
İdeal Gaz Yasası
İdeal Gazların Yoğunluğu (d)
- İdeal gazların yoğunluğunu iki şekilde hesaplayabiliriz.
- Yoğunluğun genel formülü ile:
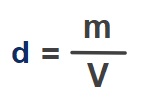
- d: Gazın özkütlesi veya yoğunluğudur. Birimi g/L olmalıdır.
- m: Gazın kütlesidir. Birimi g (gram) olmalıdır.
- V: Gazın hacmidir. Birimi L (Litre) olmalıdır.
- İdeal gaz denklemi yardımı ile:

- P: Gazın basıncıdır. (atm)
- MA: Gazın mol ağırlıdığıdır. (gram/mol)
- d: Gazın özkütlesi veya yoğunluğudur. Birimi g/L olmalıdır.
- R: İdeal gaz sabitidir.
- T: Gazın sıcaklığıdır. (K)
İdeal Gaz Yasası
İdeal Gazların Yoğunluğu (d)
- İdeal gaz denkleminden yoğunluk formülü şöyle türetilir:
- İdeal gaz denklemini yazalım:

- Mol sayısının formülünü hatırlayalım:
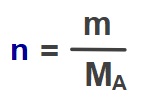
- Mol sayısı formülünü yerine yazdığımızda:

- V ile MA ifadelerinin yerini değiştirirsek:

- Yoğunluk formülü:
m/V değeri, yoğunluğun (d) formülüdür.
m/V ifadesinin yerine, d yazdığımızda, eşitlik şöyle görünecektir:

Bu formüldeki yoğunluk değerinin birimi gram / Litre olacaktır.
Örnek:
2,73 atm basınç altındaki X gazının, sıcaklığı 0 oC olarak hesaplanıyor.
Buna göre, bu gazın yoğunluğunu hesaplayınız. (X: 82 g/mol)
Örnek:
27 oC sıcaklıkta, 4 gram CH4 gazının kabına uyguladığı basınç 0,25 atm’dir.
Buna göre, kabın hacmini Litre olarak hesaplayınız. (C: 12 g/mol, H: 1 g/mol)
Örnek:
Bir depolama tankında, 380 Torr basınç yapan ve 0 oC sıcaklıkta He gazı bulunmaktadır.
Tankın hacmi 4,48 L olduğuna göre, gazın kütlesi kaç gramdır? (He: 4 g/mol)
Örnek:
6 gram C2H6 gazı, normal koşullarda kaç litre hacim kaplar? (C: 12 g/mol, H: 1 g/mol)
Örnek:
0,02 mol Al metali aşağıdaki tepkimeye göre tamamen harcanıyor:
Al(k) + 3HCl(suda) → AlCl3 + 3/2H2(g)
Buna göre bu tepkimede oluşan hidrojen gazının, 1,12 litrelik bir kapta, 0oC’deki basıncı kaç atm’dir?
A) 0,20
B) 0,30
C) 0,40
D) 0,50
E) 0,60

Gazlar
II. Bölüm
(İdeal Gaz Yasası)
Bitti 🙁